室工大ニュース
治療薬輸送⾼分⼦ミセルの⽣理⾷塩⽔中での相互作⽤を解明しました
千葉⼤学⼤学院理学研究院の森⽥ 剛 准教授、同⼤理学部の⾼松 駿佑 ⽒(研究当時)、同⼤⼤学院薬学研究院の齋藤 美波 ⽒、東 顕⼆郎 准教授、⻑浜バイオ⼤学バイオサイエンス学部の今村 ⽐呂志 助教、室蘭⼯業⼤学⼤学院⼯学研究科の墨 智成 教授の研究グループは、優れた治療薬送達作⽤を持つドラッグナノキャリアとして重要な⾼分⼦ミセルについて、⽣理⾷塩⽔中でのミセル間相互作⽤を精密に定量化することに成功しました。これにより、より⽣体内条件に近い環境で、特徴的な治療薬の輸送や放出の挙動についての基本メカニズムの理解や予測が可能となりました。さらに今回の結果から、⽣理⾷塩⽔中に含まれる浸透圧調整物質(イオン)が、⾼分⼦ミセルなどの治療薬輸送の特性や徐放性に寄与している可能性も⽰唆されました。
この成果により、今後のドラッグナノキャリアの研究において、難溶解性治療薬の薬理効果を⾼め、治療薬投与における⾝体的・精神的な負担を軽減する技術の⾼度化などへの貢献が期待されます。
本研究成果は、2025年12⽉9⽇に、学術誌Journal of Colloid and Interface Scienceでオンライン公
開されました。
研究の背景
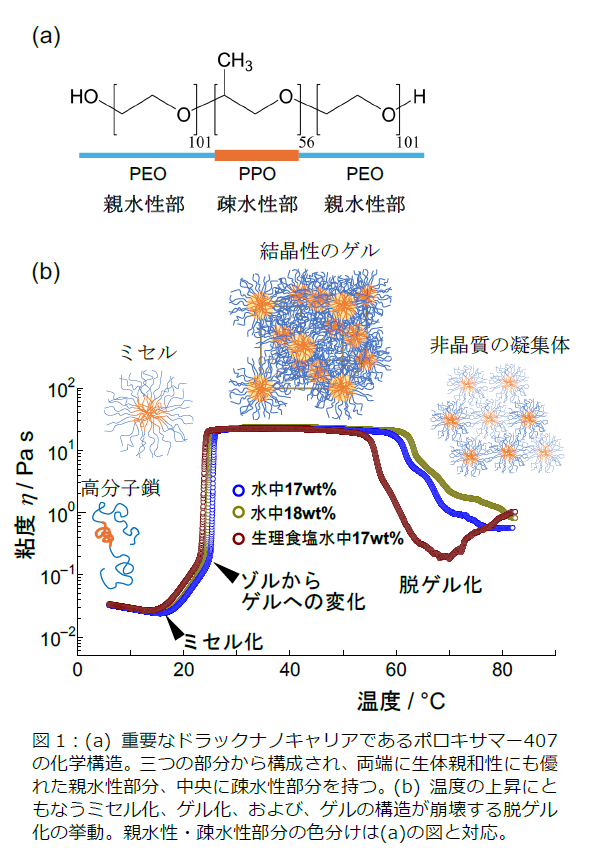
⾼分⼦ミセルは、⾼分⼦の鎖同⼠が⾃⼰集合し、例えば⽔溶液中では疎⽔性の部分が内側(コア︓図1 のオレンジ部)、親⽔性部が外側(シェル︓図1 の⽔⾊部)に配置された構造を持つ集合体です。図1は、両端が親⽔性部、中央に疎⽔性部を持つ「ポロキサマー407(P407)」とよばれる⾼分⼦鎖について、⽔溶液中でのミセル化、ゲル化、脱ゲル化の様⼦を、粘度変化とともに⽰しています。⾷品のゼリーなどとは逆で、温度の上昇によりゲル化し、ゲルは体温付近で最も安定になります。
近年、創薬研究において⾼い薬理効果を⽰す化合物の複雑化、分⼦サイズや疎⽔性の増加が顕著になり、服⽤に際する⽔への溶解性の低下が問題となっています。これを解決するため、様々な改善⽅法が研究されており、⾼分⼦ミセルによる包含もその⼀つです。疎⽔性の治療薬が、同じく疎⽔性であるミセルのコア部分に多量に包含されることで溶解度が⼤幅に改善されます。
さらに、⼀部の⾼分⼦ミセルは、優れた徐放性を持つキャリアとして知られ、治療薬による副作⽤の軽減や投
与回数を減らすことにつながり、治療薬投与に際する負担を⼤きく和らげることができます。優れた徐放性は、図1bに⽰すゼリー状の固体であるゲル内で、ミセル間に特徴的な引き合う⼒が⽣じることによる特殊な安定性に起因しているとされています。
しかし、実際の⽣体内環境下や⽣理⾷塩⽔中において、どのような相互作⽤がミセル間に⽣じているかは解
明されていませんでした。これは、⾼分⼦ミセルそのものの構造の複雑さに加え、⽣体内や⽣理⾷塩⽔中での
複雑な環境においては、従来多く⽤いられてきた粒⼦間相互作⽤をモデル関数に基づいて表す⼿法では正確
な情報を得ることは難しく、根本的な仕組みの理解には⾄っていなかったためです。
研究の成果
そこで本研究では、特別に設計・製作した装置を⽤いた放射光X 線散乱測定などによる精密な実験データ
と解析理論を融合させた独⾃の⼿法を適⽤することで、⽣体内環境を想定し、⽣理⾷塩⽔中における⾼分⼦ミ
セル間の相互作⽤の解明に取り組み成功しました。実験は、⽣体内環境での実験に広く⽤いられるリン酸緩衝
⽣理⾷塩⽔PBS(-)中において、⼩⾓X 線散乱法とよばれる実験⼿法で得られる数〜数百ナノメートル程度
(メゾスケール)での構造情報に、動的光散乱法により得られる単独のP407⾼分⼦鎖やミセル、これらの集合
状態に関するサイズ等の構造情報を組み合わせることによって、ミセル同⼠の互いの位置関係を表す構造情
報(構造因⼦)を計測解析し、この構造因⼦に基づいてミセル間相互作⽤を計算しました。
その結果、ゲルが形成される段階において、⽔中より⽣理⾷塩⽔中でミセル間の相互作⽤を表すグラフがマ
イナス側に⼤きな値を⽰しており、引⼒的相互作⽤が⽔中より⽣理⾷塩⽔中で強くなっていることが⽰され
ました(図2)。
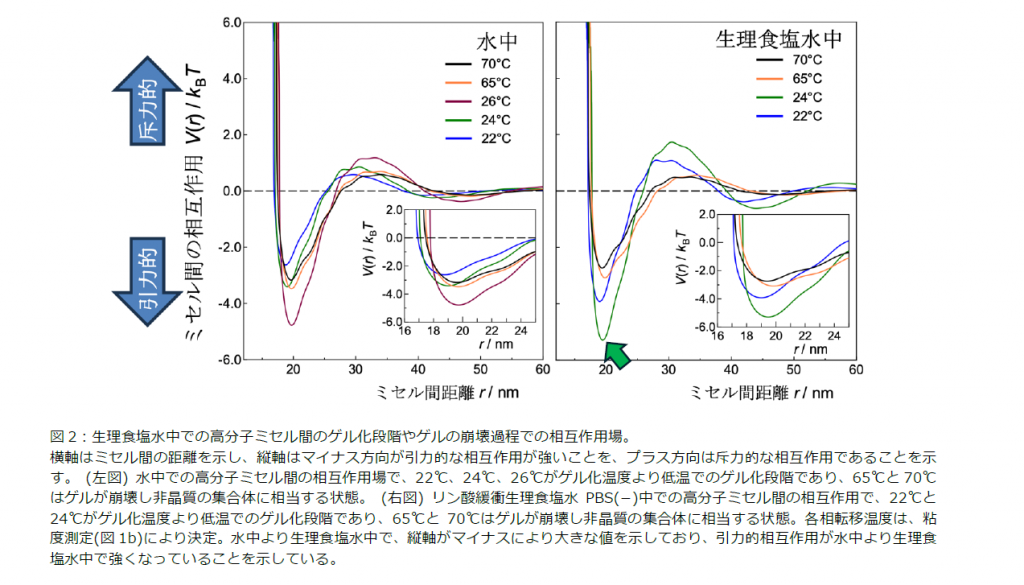
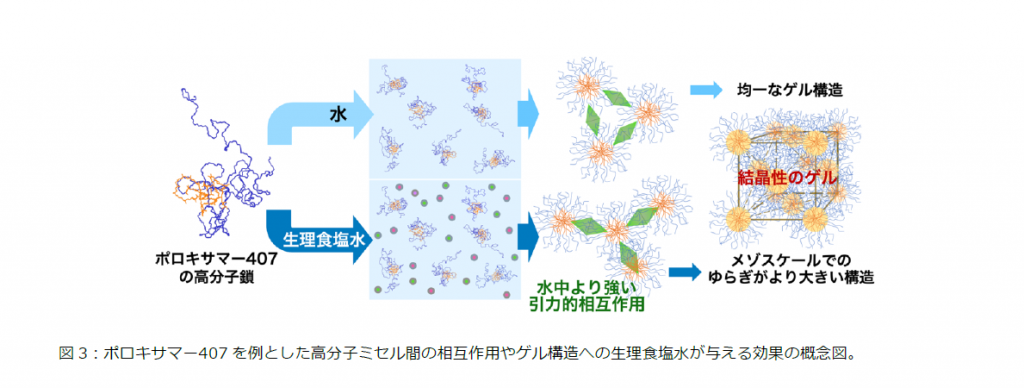
また、⾼分⼦ミセル、例えばP407 は、結晶相であるゲルを形成する過程において、Alder(アルダー)転移とよばれる乱雑さの相違のみに起因し、⾮晶質(ゾル)から結晶相(ゲル)への変化を⽰しますが、関連した基本原理として、この結晶化過程では系を構成する粒⼦がより整然と整列しつつも粒⼦周囲の空間が増すことが知られています。本研究において、⾼分⼦ミセルのゲル化の過程で、ミセル間が互いに距離を離す挙動が突き⽌められました。例えば、図2の右図で、⽣理⾷塩⽔中での22℃(⻘線)から24℃(緑線)の変化において、安定化する位置や緑⽮印部分の極⼩点位置が24℃で遠⽅にあります。この挙動から理解できることとして、⽣理⾷塩⽔中での脱ゲル化温度の低下があります(図1b)。より強い引⼒相互作⽤をミセル間が持つ場合は、ゲル化過程において、結晶化が均⼀でなくなり密集した凝集状態を残存させ、メゾスケールで観察される構造のゆらぎが⽣じます。この構造のゆらぎが、ゲルの崩壊を進⾏させることで、⽔中より⽣理⾷塩⽔中で、脱ゲル化が低温で⽣じるとするメカニズムが提案されました(図3)。
ナノキャリアとしての特性をつかさどる⾼分⼦ミセル間の相互作⽤の理解が進んだことから、複雑さのため従来の技術では困難であった⽣理⾷塩⽔中など、より⽣体内条件に近い環境での治療薬徐放性やゲル化挙動の詳細な基本メカニズムの理解や挙動予測が可能となりました。さらに今回の結果から、⽣理⾷塩⽔中に含まれる浸透圧調整物質(イオン)が⾼分⼦ミセルなどの治療薬送達特性や徐放特性に寄与している可能性も⽰唆されました。
今後の展望
本研究により、⽣体内環境に近い複雑な状態での、相互作⽤に関するその場観測が可能となり、基礎科学的に重要な研究課題であるコロイド粒⼦間の相互作⽤に対する塩効果に関して、より深い知⾒を⾒出すことへの貢献はもとより、さまざまな治療薬キャリアや各種治療薬の作⽤への適⽤、体内条件での知⾒を得ることができるため、今後のドラッグナノキャリアの研究において、難溶解性治療薬の薬理効果を⾼め、治療薬投与における⾝体的・精神的な負担を軽減する技術の⾼度化などへの貢献が期待されます。
研究プロジェクトについて
本研究は、科学研究費助成事業「⾼分⼦ナノミセルの相互作⽤場に⽴脚した治療薬徐放作⽤の起源に関する研究」(23K23156)の⽀援にて⾏われました。
論文情報
タイトル︓Clarifying Pair Interaction Potential between Poloxamer 407 Micelles Solvated into Phosphate-Buffered Saline in Sol-Gel-Sol Transition
著者︓Takeshi Morita, Shunsuke Takamatsu, Hiroshi Imamura, Minami Saito, Kenjirou Higashi, and
Tomonari Sumi
雑誌名︓Journal of Colloid and Interface Science
DOI︓10.1016/j.jcis.2025.139642
本学研究者連絡先
室蘭⼯業⼤学⼤学院⼯学研究科 墨 智成
TEL︓0143-46-5724
メール︓sumi@muroran-it.ac.jp
報道に関するお問い合わせ
国立大学法人室蘭工業大学総務広報課秘書広報係
TEL:0143-46-5008 FAX:0143-46-5035
E-mail:koho@muroran-it.ac.jp